Biologiczne mechanizmy molekularne. Eksperymentalne poparcie dla wniosku o projekcie
Od tłumacza:
Prezentowany tekst dotyczy biochemii. Jego autor, dr Michael J. Behe (ur. 1952), jest profesorem Wydziału Chemii Uniwersytetu Lehigh w Bethlehem, Pennsylvania, USA. Jest to tekst wystąpienia na sympozjum zatytułowanym "Inteligentny Projekt" zorganizowanym przez American Scientific Affiliation, amerykańską organizację, grupującą uczonych o przekonaniach chrześcijańskich (większość w niej stanowią jednak ewolucjoniści). Główne idee tego eseju są następujące:
- w ciągu ubiegłych pięćdziesięciu lat biochemia odkryła bardzo dużo z tego, co nazwać można molekularną podstawą życia - jego fundamentalnym poziomem fizycznym - i wiedza ta była niedostępna dla Darwina i tych, którzy wymyślili teorię ewolucji;
- wiele (choć nie wszystkie) struktury, jaki widzimy na tym mikroskopowym poziomie, są nadzwyczaj złożone;
- wiele z tych struktur wydaje się być nieredukowalnie złożonymi, przez co należy rozumieć to, że zbudowane są one z licznych części, z których wszystkie muszą być obecne, aby całość funkcjonowała;
- jeśli struktury te faktycznie są nieredukowalnie złożone, to nie mogły wyewoluować w stopniowych krokach, jak chciałby darwinizm, ponieważ dopóki struktura ta nie zostanie skompletowana, nie istnieje żadna funkcja, którą dobór naturalny mógłby selekcjonować;
- przegląd literatury biochemicznej na temat ewolucji molekularnej opublikowanej w ciągu ostatnich dziesięciu lat ujawnia wielkie ZERO artykułów proponujących szczegółowe, testowalne modele stopniowej ewolucji jakiegokolwiek znanego systemu biochemicznego.
Przy tempie zera artykułów w ciągu każdych dziesięciu lat, upłynie bardzo wiele czasu, zanim nauka przedstawi obiecane wyjaśnienia na temat, jak rozwinęło się życie. Behe uważa, że nieredukowalna złożoność większości systemów biochemicznych w połączeniu z wyraźnym paraliżem nauki, jeśli chodzi o znane mechanizmy, jest przekonującym świadectwem, iż mechanizmy te zostały zaprojektowane przez jakiś inteligentny czynnik. Biochemia jako taka nie potrafi przyczynić się do identyfikacji tej inteligencji, ale dobrze spełnia swoją rolę w zakresie, w jakim to jest możliwe.
Dr Michael J. Behe jest katolikiem, co zasługuje na podkreślenie w obliczu faktu, że zdecydowaną większość amerykańskich kreacjonistów stanowią protestanci.
Wprowadzenie
W ciągu krótkiego czasu po opublikowaniu przez Charlesa Darwina jego książki O pochodzeniu gatunków, wyjaśniającą moc teorii ewolucji uznała większość biologów. Hipoteza ta łatwo rozwiązała problemy podobieństwa homologicznego, organów szczątkowych, obfitości gatunków, wymierania i biogeografii. Rywalizująca ówczesna teoria, która postulowała bezpośrednie stworzenie gatunków przez jakąś nadnaturalną istotę, wydawała się większości racjonalnych umysłów dużo mniej dogodna, gdyż domniemany Stwórca zajmowałby się takimi szczegółami, że byłoby to uwłaczaniem Jego godności. Z upływem czasu teoria ewolucji wyrugowała tę rywalizującą teorię specjalnego stworzenia i praktycznie rzecz biorąc wszyscy uczeni badali świat biologiczny z perspektywy darwinowskiej. Większość wykształconych ludzi żyła odtąd w świecie, w którym cudowność i bogactwo królestwa życia zostały wytworzone przez prostą i elegancką zasadę doboru naturalnego.
Jednak w nauce bywa tak, że teoria odnosząca sukces niekoniecznie jest teorią poprawną. W dziejach nauki istniały także inne teorie, które osiągnęły ten sam tryumf, jaki zdobył darwinizm: ujęły wiele eksperymentalnych i obserwacyjnych faktów w spójnej ramie roboczej i odpowiadały intuicjom ludzi na temat, jak świat powinien funkcjonować. Teorie te także obiecywały wyjaśnić wiele cech wszechświata przy pomocy kilku prostych zasad. Lecz wiele z tych teorii jest obecnie martwych. Zasługuje na ironię fakt, że zostały one zniszczone przez ten sam postęp nauki, do jakiego się przyczyniły. Dobrym tego przykładem jest zastąpienie Newtonowskiego mechanicznego ujęcia wszechświata przez Einsteinowski wszechświat relatywistyczny. Chociaż model Newtona wyjaśniał rezultaty wielu eksperymentów przeprowadzonych w czasach tego uczonego, to nie udało mu się wyjaśnić aspektów grawitacji. Einstein rozwiązał ten i inne problemy, rozważając na nowo strukturę wszechświata.
Tak więc wiele teorii wiodło pomyślny żywot w swoim czasie, ale zostało odrzuconych, gdy nie mogły wyjaśnić nowych danych, udostępnionych przez postęp nauki. Podobnie Darwinowska teoria ewolucji miała się znakomicie, wyjaśniając wiele danych swego czasu oraz pierwszej połowy wieku XX-go, ale - co będzie celem mojego wystąpienia - darwinizm okazał się być niezdolny do wyjaśnienia zjawisk odkrytych wysiłkiem współczesnej biochemii w ciągu drugiej połowy tego stulecia. Cel swój osiągnę podkreślając fakt, że życie na swoim najbardziej podstawowym poziomie jest nieredukowalnie złożone i że taka złożoność jest niezgodna z niekierowaną ewolucją.
Tryumf współczesnej biochemii
Chociaż Darwin i jego współcześni byli świadomi szerokiego zakresu zjawisk biologicznych, z powodu ograniczeń dziewiętnastowiecznej nauki wszystkie systemy biologiczne były w istocie czarnymi skrzynkami. [1] Analizując oko, Darwin odrzucił kwestię jego ostatecznego mechanizmu stwierdzając, że to, "w jaki sposób nerw stał się wrażliwy na światło, nie obchodzi nas bardziej niż to, w jaki sposób powstało samo życie". [2] Pytanie "jak funkcjonuje oko?" - czyli co się dzieje, kiedy foton światła pada na siatkówkę? - nie mogło uzyskać odpowiedzi w owym czasie. Faktycznie żadne pytanie na temat podstawowego mechanizmu życia nie mogło znaleźć odpowiedzi w tamtej epoce. Jak muskuły zwierząt wywołują ruch? Jak funkcjonuje fotosynteza? Jak z pożywienia wydobywa się energię? Jak organizm zwalcza infekcję? Na wszystkie takie pytania nie było odpowiedzi.
 |
Wydaje się, że cechą charakterystyczną ludzkiego umysłu jest to, że gdy nie istnieją ograniczenia ze strony wiedzy na temat mechanizmu jakiegoś procesu, to łatwo wyobraża on sobie proste kroki prowadzące do jego funkcjonowania. Ilustruje to historyjka obrazkowa "Calvin and Hobbes". Ponieważ małe dziecko, jak Calvin, nie wie, jak funkcjonują samoloty, łatwo wyobraża sobie, że (czarna) skrzynka może równie dobrze latać jak samolot. Jednak dorośli wiedzą, że samoloty są bardzo złożonymi maszynami i nie wierzą w latające skrzynki.
 |
W świecie biologicznym układy złożone również początkowo mogą wydawać się proste. Dobrym tego przykładem jest wiara w spontaniczne powstawanie życia. Zwolennik Darwina, Ernst Haeckel, znany jest między innymi ze swego poparcia dla teorii abiogenezy - powstawania życia z materii nieożywionej bez udziału rodziców. Kiedy statek badawczy H.M.S. "Cyclops" wydobył z dna morza trochę dziwnie wyglądającego mułu, to nawet taki autorytet, jak Thomas Henry Huxley, był przekonany, że była to protoplazma, poprzednik samego życia. Huxley nazwał ten muł Bathybius Haeckelii, czcząc w ten sposób Haeckla, znanego zwolennika abiogenezy. [3] Chociaż epizod ten wydaje się nam sto lat później niepoważny, to należy zwrocić uwagę, że Haeckel (uważający, że komórki są "jednorodnymi kuleczkami plazmy") i Huxley łatwo uwierzyli, że komórki mogą powstać z prostego mułu, ponieważ nie zdawali sobie sprawy ze złożoności komórek. Jednak gdy złożoność nawet najprostszego jednokomórkowego organizmu stała się widoczna, wiara w spontaniczne powstawanie życia zanikła. Obecnie nie istnieje uczony, który by utrzymywał, że złożone organizmy, organy czy organelle mogą w naturalny sposób powstać w jednym kroku z prostych składników wyjściowych.
Ernst Mayr powiedział, że "każda rewolucja naukowa musi zaakceptować wszelkiego rodzaju czarne skrzynki, gdyż gdybyśmy czekali do otwarcia wszystkich czarnych skrzynek, nigdy nie nastąpiłby postęp pojęciowy". [4] Jest to prawda, ale celem nauki jest otwieranie tych czarnych skrzynek i gdy już zawartość tych skrzynek jest ujawniona, należy przygotowywać wstępne teorie na temat ich mechanizmów. Wspaniałe osiągnięcia współczesnej biochemii polegają na tym, że otworzyła ona czarne skrzynki wielu systemów biologicznych i określiła na poziomie molekularnym, jak one funkcjonują. Chociaż dla Darwina podstawowy proces widzenia był czarną skrzynką, to wiemy obecnie, [5] że gdy światło pada na siatkówkę, cząsteczka organiczna, zwana 11-cis-retinal, absorbuje foton, co powoduje, że przekształca się ona na transretinal. Zmiana kształtu cząsteczki retinalu powoduje zmianę kształtu białka membranowego, rodopsyny, do której ona ściśle przylega. To odmienione białko oddziaływuje wówczas na białko przekaźnikowe, zwane transducyną, które zaczyna aktywować związane z membraną białko zwane fosfodiesterazą. Fosfodiesteraza zaś uwalnia jony wapnia z pręcikowych komórek oka, co hamuje transport jonów sodu przez komórkę. To z kolei powoduje hiperpolaryzację membrany komórkowej i w końcu wywołuje prąd, który przepływa w dół nerwu optycznego do mózgu. Oto co znaczy "wyjaśnić" widzenie. To jest poziom wyjaśnienia, do którego zmierzają nauki biologiczne.
Teorię Darwina sformułowano, kiedy cała biologia składała się z czarnych skrzynek. W tym referacie zbadam kilka układów biologicznych na poziomie molekularnym i sprawdzę, czy dobór naturalny nadal wydaje się być wystarczającym wyjaśnieniem w chwili obecnej, gdy wiele czarnych skrzynek zostało otwartych.
Białka
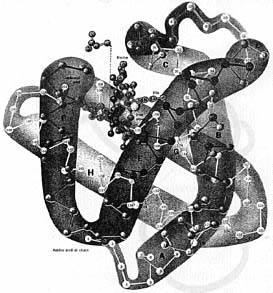 |
Zastanówmy się najpierw nad najbardziej podstawowymi narzędziami komórki. Biochemia wykazała, że mechanizmami w żywej tkance, które budują struktury i przeprowadzają reakcje chemiczne konieczne dla życia, są cząsteczki zwane białkami. Podstawowa struktura białek jest dość prosta (patrz rys.): ukształtowane są przez nieciągłe podjednostki, zwane aminokwasami, które są sczepione w postaci łańcucha. Każdy z dwudziestu odmiennych rodzajów aminokwasów ma odmienny kształt i odmienne własności chemiczne, a typowy łańcuch białkowy składa się z około 50 do około 1 000 aminokwasowych ogniw.Ale białko w komórce nie pływa jak wiotki łańcuch (patrz rys. na lewo); raczej tworzy ono bardzo precyzyjną strukturę, która może być bardzo różna dla różnych typów białek; to właśnie struktura tak złożonego białka dokładnie determinuje funkcję, jaką ono pełni. A ponieważ sposób ułożenia i pofałdowanie białka zdeterminowany jest przez sekwencję aminokwasów, to sekwencja ta także determinuje funkcję białka. Nowoczesna biochemia zaczęła istnieć w przybliżeniu czterdzieści lat temu, kiedy nauka rozwinęła się do tego stopnia, że mogła określić dokładne struktury tych podstawowych cząsteczkowych składników układów biologicznych. Kiedy J.C. Kendrew ze współpracownikami określił pierwszą strukturę białka dla mioglobiny, białka występującego w mięśniu, to najbardziej uderzającą cechą dla niego była złożoność i brak symetrii tej cząsteczki. [6] A jego kolega, laureat nagrody Nobla, Max Perutz, wydawał się znajdować w najwyższej rozpaczy, gdy zauważył:
 |
Czy to możliwe, by poszukiwanie ostatecznej prawdy rzeczywiście doprowadziło do ujawnienia tak obrzydliwego i podobnego do trzewi obiektu? [7]
(Mioglobina przypomina jelita.) Zanim ujawniono strukturę mioglobiny, większość uczonych oczekiwała, że ta białkowa czarna skrzynka zawiera proste, regularne cząsteczki, podobne do kryształków soli, i złożoność, jaką ujrzeli, zaskoczyła ich. Chociaż biochemicy przyzwyczaili się już do kształtu białek i stopniowo polubili je, złożoność tych struktur pozostaje.
 |
Rozpoznanie struktur białek spowodowało, że uczeni zaczęli się zastanawiać, jakie jest prawdopodobieństwo, by jakaś sekwencja aminokwasów mogła uformować złożoną postać konkretnego zwartego, funkcjonalnego białka. Od dawna wiadomo, że chociaż różne klasy białek mają odmienne sekwencje aminokwasów i różne kształty, że analogiczne białka z różnych gatunków, na przykład hemoglobina człowieka i hemoglobina konia, różnią się swoimi sekwencjami aminokwasów, to jednak formują podobne struktury. Ale wiadomo także, że zmiany niektórych aminokwasów niszczą strukturę białka. Jakie są więc granice tolerancji dla zmian aminokwasów? Jakie jest prawdopodobieństwo znalezienia jakiegoś konkretnego białka w nieukierunkowanym badaniu?
W ciągu ostatnich kilku lat odpowiedzi na te pytania nadeszły z laboratorium Roberta Sauera na Wydziale Biologii Massachusetts Institute of Technology. [8] W laboratorium Sauera pobierano geny dla kilku białek wirusowych (patrz rys. powyzej), systematycznie rozdrabniano je na części i wstawiano odmienne fragmenty z powrotem do genów. Te zmienione geny umieszczano wówczas ponownie w bakteriach, które odczytywały kod DNA i produkowały z nich łańcuchy aminokwasów. Okazało się, że bakterie te szybko niszczyły białka, które nie były odpowiednio przestrzennie ułożone. Grupa Sauera poszukiwała więc takich odmienionych białek, które nie zostały zniszczone. Określając ich sekwencje, mogli powiedzieć, które aminokwasy w danym miejscu zgodne były z tworzeniem złożonego przestrzennie, funkcjonalnego białka podobnego do białka rodzicielskiego.
R
K R R
G D K
T N E
A H T
M S K G
K V A G S
L F M S M
E I L M K L
- N - L - E - D - A - R - R - L - K - A -
4 10 9 1 1 5 2 1 1 9
* -- * -- * -- * -- * -- * -- * -- * -- * -- * -- *
20 20 20 20 20 20 20 20 20 20
1 na 1065 to tyle, co jedna szansa na
100 000 000 000 000 000 000 000 000 000 000 000 000 000 000 000 000 000 000 000 000 000
|
Grupa Sauera zauważyła, że w niektórych miejscach białka tolerowana była duża rozmaitość aminokwasów (patrz rys. powyżej). W niektórych miejscach mogło wystąpić do 15 spośród 20 aminokwasów i nadal dawać funkcjonalne, przestrzennie ustrukturowane białko. Jednak w innych miejscach w sekwencji aminokwasów tolerowane mogło być bardzo niewielkie zróżnicowanie. Wiele miejsc mogło przyjąć tylko 3 lub 4 odmienne aminokwasy. Inne miejsca miały absolutny wymóg na tylko konkretny aminokwas; znaczy to, że jeśli - powiedzmy - P nie występuje w miejscu 78 danego białka, to białko nie przybierze charakterystycznego przestrzennego kształtu, pomimo tego, że reszta sekwencji jest zbliżona do białka naturalnego.
Z faktycznych wyników eksperymentalnych grupy Sauera, jak to pokazuje rysunek, można łatwo obliczyć, że prawdopodobieństwo znalezienia złożonego białka wynosi około 1/1065 [9] Liczba ta jest niemal identyczna z wynikami otrzymanymi wcześniej przy pomocy obliczeń teoretycznych i to podobieństwo wyników wielce wzmacnia nasze zaufanie, że otrzymano poprawny wynik. Aby wyrobić sobie opinię na temat tej fantastycznie małej liczby, wyobraźmy sobie, że ktoś schował ziarnko piasku, oznaczone maleńkim "X"-em, gdzieś na pustyni Sahara. Po kilkuletnim włóczeniu się na ślepo po tej pustyni, schylasz się i znajdujesz to maleńkie "X". Żywiąc podejrzenia, dajesz to ziarenko piasku komuś, by je ponownie schował, znowu błąkasz się ślepo po pustyni, schylasz się i jeszcze raz podnosisz to samo ziarenko oznaczone "X"-em. Trzeci raz powtarzasz swoje działania i trzeci raz znajdujesz oznaczone ziarenko. Prawdopodobieństwo znalezienia tego oznaczonego ziarenka piasku na pustyni Sahara trzy razy pod rząd jest mniej więcej takie samo, jak znalezienia jednej nowej funkcjonalnej struktury białka, jednego z podstawowych narzędzi komórki. Większość ludzi uzna raczej, że cała sprawa została z góry ukartowana, niż że jest to wynik szczęśliwego nałożenia się przypadków.
Wielki postęp w biochemii w ciągu ostatnich czterdziestu lat wykazał, że podstawowe narzędzia życia, białka, są nadzwyczaj złożone. Perutz i Kendrew byli zaskoczeni, kiedy - oczekując prostoty - natknęli się po raz pierwszy na złożoność mioglobiny. Chociaż z upływem czasu nowość struktury mioglobiny utraciła na ostrości, doznajemy podobnego zaskoczenia, kiedy nowe eksperymenty, podobne do eksperymentów wykonywanych przez grupę Sauera, odnawiają nasze rozumienie złożoności funkcjonalnych białek, która odzwierciedlona jest w bardzo małym prawdopodobieństwie ich wystąpienia.
Mechanizmy molekularne
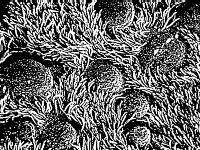
Mikroskop elektronowy ujawnia wyścieloną rzęskami powierzchnię nabłonkową przewodu oskrzelowego oraz okrągłe powierzchnie wielu komórek kubkowych wydzielających śluz. Jednostki obciążone dziedzicznymi defektami, dotyczącymi rzęsek, cierpią na stałe infekcje dróg oddechowych, będące wynikiem ich zmniejszonej zdolności do wydalania obcych cząstek. (za R.G. Kessel and R.H. Kardon, Tissues and Organs: A Text-Atlas of Scanning Electron Microscopy, W.H. Freeman and Company 1979, s.210) |
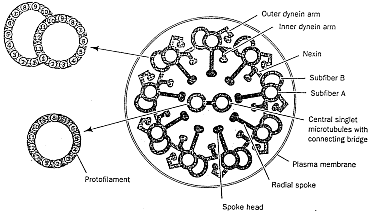
Mimo tego, że skręcone białka są bardzo złożone i w rezultacie mało prawdopodobne, do wielu celów złożoność ta nie wystarcza. W wielu strukturach biologicznych białka są po prostu składnikami większych systemów molekularnych. Tak jak kineskop, przewody, metalowe sworznie i śruby składają się na odbiornik telewizyjny, tak wiele białek jest częściami struktur, które funkcjonują jedynie wówczas, gdy zebrane są razem wszystkie składniki. Dobrym tego przykładem jest rzęska (patrz rys. obok). Jak to zostało opisane w podręczniku uniwersyteckim, [10] rzęski są podobnymi do włosów organellami, występującymi na powierzchni komórek wielu zwierząt i niższych roślin, służącymi do poruszania płynu wokół powierzchni komórki albo do poruszania się pojedynczych komórek w tym płynie. U ludzi na przykład każda z komórek nabłonkowych, wyściełających drogi oddechowe, ma około 200 rzęsek, które uderzają synchronicznie, aby przesunąć śluz ku gardłu i go usunąć. Rzęska składa się z okrytej membraną wiązki włókien zwanej aksonemem (rys. u góry). Aksonem ma pierścień zbudowany z 9 podwójnych mikrotubul otaczających dwie centralne pojedyncze mikrotubule. Każdy zewnętrzny dublet składa się z pierścienia 13 filamentów [nici] (podwłókna A), zrośniętego z zespołem 10 filamentów (podwłóknem B). Filamenty mikrotubul składają się z dwu białek zwanych tubuliną alfa i beta. 11 mikrotubul kształtujących aksonem jest utrzymywanych razem przez trzy typy złączy: podwłókna A są połączone z centralnymi mikrotubulami przy pomocy promieniowych szprych [radial spokes]; dublety zewnętrzne są połączone złączem składającym sie z wysoce elastycznego białka zwanego neksyną; a centralne mikrotubule połączone są mostkiem. W końcu każde podwłókno A ma dwa ramiona, wewnętrzne i zewnętrzne, składające się w obu przypadkach z białka dyneiny.
 |
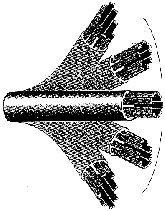 |
Ale jak funkcjonuje rzęska? (Patrz rys. poniżej) Eksperymenty pokazały, że ruch rzęskowy jest wynikiem chemicznie napędzanego "wędrowania" ramion dyneinowych na jednej mikrotubuli do sąsiedniego podwłókna B drugiej mikrotubuli, tak że te dwie mikrotubule przesuwają się względem siebie. Jednak białkowe powiązania między mikrotubulami w nieuszkodzonym rzęsku uniemożliwia sąsiednim mikrotubulom przesuwać się więcej niż na krótką odległość. Dlatego te powiązania przekształcają indukowany przez dyneinę ruch przesuwania mikrotubul w zginający ruch całego aksonemu (patrz rys. obok).
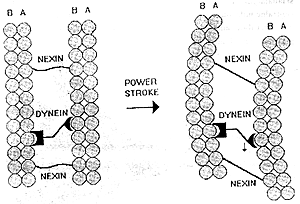 |
A teraz siądźmy sobie spokojnie, zastanówmy się nad funkcjonowaniem rzęski i rozważmy, jakie płyną z niego konsekwencje. Rzęski zbudowane są z przynajmniej pół tuzina białek: alfatubuliny, beta-tubuliny, dyneiny, neksyny, białka budującego wspomniane szprychy i białka mostka centralnego. Wszystkie one łącznie spełniają jedno zadanie, ruch rzęskowy. Aby rzęska funkcjonowała, wszystkie one muszą być obecne. Jeśli nie ma tubulin, nie ma filamentów, które mogłyby się przesuwać; jeśli brakuje dyneiny, to rzęska pozostaje sztywna i w bezruchu; jeśli brakuje neksyny lub innych białek łączących, to aksonem rozpada się, gdy filamenty się przesuną. A więc to, co widzimy w rzęsce, to nie tylko głęboka złożoność, ale jest to także złożoność nieredukowalna na skalę molekularną. Przez "nieredukowalną złożoność" rozumiem mechanizm, który wymaga licznych odrębnych składników, aby całość funkcjonowała. Dobrymi przykładami z codziennego życia są śruba i nakrętka, blok i lina albo podpora i dźwignia. W tych prostych urządzeniach wszystkie składniki muszą być obecne, aby mogły one funkcjonować. Podobnie i rzęska, tak jak jest zbudowana, musi mieć przesuwające się filamenty, białka łączące oraz białka motoryczne, aby mogła funkcjonować. Przy nieobecności choćby jednego z tych składników, urządzenie to jest bezużyteczne.
Składnikami rzęsek są pojedyncze molekuły. Oznacza to, że nie ma już czarnych skrzynek, do których można by się odwołać; złożoność rzęski jest ostateczna, fundamentalna. Uczeni, poznając złożoność komórki, uświadomili sobie w końcu, jak nierozsądne było myślenie, iż życie powstało spontanicznie w pojedynczym kroku lub w kilku krokach ze szlamu oceanicznego. Podobnie i my obecnie uświadamiamy sobie, że złożona rzęska nie mogła powstać w pojedynczym kroku lub w kilku krokach. Ale ponieważ złożoność rzęski jest nieredukowalna, nie mogła ona mieć funkcjonalnych prekursorów. Pytanie "co mogło być funkcjonalnym poprzednikiem rzęski?" należy do tej samej logicznej kategorii co pytanie "jaki dźwięk wydaje jedna klaszcząca ręka?" Ponieważ nieredukowalnie złożona rzęska nie mogła mieć funkcjonalnego prekursora, to i nie mogła zostać wytworzona przez dobór naturalny, który wymaga pewnej stopniowalnej funkcji. Dobór naturalny jest bezsilny, kiedy nie istnieje funkcja, którą mógłby on selekcjonować. Możemy pójść dalej i powiedzieć, że jeśli rzęska nie mogła być wytworzona przez dobór naturalny, to ta rzęska musiała być zaprojektowana.
Ciężar dowodu
 |
Ciężar dowodu, jaki spoczywa na obrońcach wniosku o projekcie, umieścił na nich sam Darwin w O pochodzeniu gatunków Powiedział on tam, że gdyby jakaś struktura biologiczna, nawet jedna, nie mogła być wytworzona stopniowo poprzez ciąg funkcjonalnych etapów pośrednich, to wówczas darwinowski ewolucjonizm całkowicie się załamie. Nie jest ważne, jeśli nawet sto systemów można wyjaśnić wiarygodnie doborem naturalnym; jeden kontrprzykład wystarcza do podważenia całej teorii. Taki kontrprzykład dla darwinowskiego ewolucjonizmu widzimy w rzęsce. Analizowałem tutaj rzęskę, ponieważ jako urządzenie mechaniczne jej nieredukowalność jest łatwa do uchwycenia przez różnych obserwatorów. Ale nie jest to jedyny kontrprzykład. Przykłady nieredukowalnej złożoności można znaleźć praktycznie na każdej stronie podręczników biochemii.
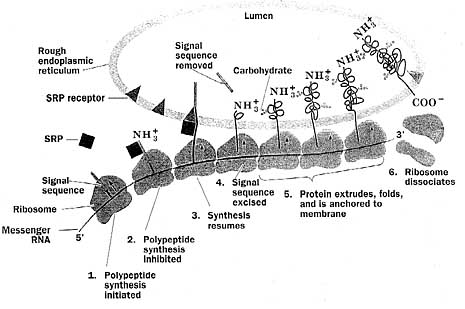
Na przykład niemechaniczną nieredukowalną złożoność można ujrzeć w systemie wysyłającym białka do przedziałów komórkowych. [11] Komórka eukariotyczna zawiera wiele komórkowych przedziałów wykonujących wyspecjalizowane zadania. Dotyczy to m.in. lizosomów do trawienia czy pęcherzyków Golgiego do wydzielania produktów białkowych na zewnątrz komórki. Niestety, mechanizm syntezy białka występuje na zewnątrz tych organelli, a więc jak białka, wykonujące zadania wewnątrz tych komórkowych przedziałów, znajdują drogę do miejsca swojego przeznaczenia? Okazuje się, że białka, które docierają do organelli, posiadają specjalną sekwencję aminokwasów blisko początku, zwaną "sekwencją sygnalną" (patrz rys. poniżej). Gdy białka są syntetyzowane przez rybosomy, z sekwencją sygnalną wiąże się złożony molekularny zespół zwany cząsteczką rozpoznania sygnału albo SRP. Powoduje on tymczasowe zatrzymanie syntezy białka. Podczas tej przerwy w syntezie białka, SRP jest związana przez transmembranowy receptor SRP, który powoduje podjęcie na nowo syntezy białka i który pozwala przejść białku do wnętrza retikulum endoplazmatycznego (ER). Gdy białko przejdzie do ER, odcinana jest sekwencja sygnalna.
 |
Dla wielu białek ER jest tylko stacją przestankową w ich podróży do miejsca ich ostatecznego przeznaczenia. Białka, kończące drogę w lizosomie, są "zaznaczone" enzymatycznie resztą węglowodanową zwaną 6-fosfomannozą albo mannozo-6-fosforanem. W rejonie membrany retikulum endoplazmatycznego zaczynają się wówczas koncentrować liczne białka; jedno z nich, klatryna, przybiera kształt pewnego rodzaju kopuły geodezyjnej (patrz rys. powyżej), zwanej opłaszczonym pęcherzykiem, który pączkuje i odrywa się od ER. W tej kopule istnieje także białko receptorowe, które wiąże zarówno klatrynę, jak i grupę 6-fosfomannozy białka, jakie ma być transportowane. Opłaszczony pęcherzyk odłącza się wtedy od retikulum endoplazmatycznego, podróżuje poprzez cytoplazmę i wiąże się z lizosomem przy pomocy innego specyficznego białka receptorowego. W końcu pęcherzyk ten zlewa się z lizosomem i białko znajduje się na miejscu swego przeznaczenia.
W czasie swej podróży nasze białko oddziaływało z dziesiątkami makromolekuł, aby osiągnąć swój cel: dotarcie do lizosomu. Potencjalnie wszystkie składniki systemu transportowego są konieczne, aby ten system działał, a więc system ten ma nieredukowalny charakter. A ponieważ wszystkie skladniki tego systemu składają się z pojedynczych lub kilku cząsteczek, nie ma żadnych czarnych skrzynek, do których można by się odwołać. Konsekwencje nawet jednego błędu w łańcuchu transportowym ujawniają się w postaci wady dziedzicznej znanej jako mukolipidoza II. Jest ona rezultatem niedoboru enzymu umieszczającego mannozo-6-fosforan na białkach, jakie mają być skierowane do lizosomów. Mukolipidoza II charakteryzuje się postępującym upośledzeniem umysłowym, deformacją szkieletu i wczesną śmiercią.
Studia nad "ewolucją molekularną"
Jest mnóstwo innych przykładów nieredukowalnej złożoności, włączając aspekty krzepnięcia krwi, zamkniętego kołowego DNA, transportu elektronowego, wici bakterii, telomerów, fotosyntezy, regulacji transkrypcji - potencjalnie każdego systemu biochemicznego. Ale jeśli nie można ich wyjaśnić darwinowską ewolucją, to jak społeczność naukowa traktowała te zjawiska w ciągu ubiegłych czterdziestu lat? Dobrym miejscem do poszukiwania odpowiedzi na to pytanie jest Journal of Molecular Evolution JME jest czasopismem, które zaczęło się szczególnie zajmować sprawą istnienia ewolucji na poziomie molekularnym. Ma wysokie standardy naukowe i jest redagowane przez znane osoby w tej dziedzinie. W ostatnim numerze JME (July 1993, vol. 37, No. 1) opublikowano jedenaście artykułów. Z nich wszystkie jedenaście dotyczyło po prostu analizy białka lub sekwencji DNA. Żaden z tych artykułów nie analizował modeli dla form pośrednich w rozwoju złożonych struktur biomolekularnych. W ciągu ubiegłych dziesięciu lat JME opublikował 886 artykułów. Z nich 95 analizowało chemiczną syntezę cząsteczek, o których sądzono, że są konieczne do powstania życia, 44 artykuły zaproponowały matematyczne modele ulepszające analizę sekwencji, 20 dotyczyło ewolucyjnych implikacji aktualnych struktur, a 719 było analizami białka lub polinukleotydowych sekwencji. Zero artykułów analizowało modele form pośrednich w rozwoju złożonych biomolekularnych struktur. Jeśli spojrzymy na inne czasopisma czy książki, ujrzymy ten sam obraz.

Liczba artykułów w Journal of Molecular Evolution w ubiegłym dziesięcioleciu, jakie analizowały szczegółowe modele stadiów pośrednich w rozwoju złożonych struktur biomolekularnych. |
A więc... jeśli w najbliższych tygodniach zdarzy się wam dyskutować tę sprawę z kolegą i on, jak Calvin i Hobbes, mówi, że nie dostrzega żadnej trudności w tym, by złożone struktury biochemiczne ewoluowały w niekierowany sposób, to powinniście zasugerować mu, aby spisał szczegółowo swoje pomysły i wysłał je do jakiegoś recenzowanego czasopisma z wnioskiem o publikację. Zapewnijcie go, że jeśli to zrobi, będzie pierwszy na tym polu. Ci z nas, [12] którzy będą twierdzili, że dobór naturalny może wyjaśnić te struktury, i mimo tego nie podejmą tego wysiłku, ujawnią swoje intelektualne lenistwo, gdyż literatura techniczna jest w tej dziedzinie jałowa.
Porównywanie sekwencji wszechwładnie dominuje w literaturze dotyczącej ewolucji molekularnej. Ale samo porównanie sekwencji nie może wyjaśnić rozwoju złożonych systemów biochemicznych, tak jak porównanie przez Darwina prostego i złożonego oka nie powiedziało mu, na czym polega widzenie. W tej dziedzinie więc nauka milczy. Znaczy to, że kiedy wnioskujemy, iż złożone systemy biochemiczne zostały zaprojektowane, nie zaprzeczamy żadnemu wynikowi eksperymentalnemu i nie popadamy w konflikt z żadnym badaniem teoretycznym. Nie musimy kwestionować żadnego eksperymentu. Należy tylko ponownie zbadać interpretację wszystkich eksperymentów, tak jak po zwróceniu uwagi na dualność fala-cząstka należało zreinterpretować wyniki eksperymentów spójnych z Newtonowskim ujęciem Wszechświata.
Wniosek
Konkludując, należy zwrócić uwagę, że nie wnioskujemy istnienia projektu z tego, czego nie wiemy, ale z tego, co wiemy. Nie dokonujemy wniosku o projekcie dla jakiejś czarnej skrzynki, ale aby wyjaśnić otwartą skrzynkę. Człowiek, należący do jakiejś pierwotnej kultury, widząc samochód, może przypuszczać, że jest on napędzany przez wiatr lub przez antylopę ukrytą pod maską, ale gdy otworzy tę maskę i zobaczy silnik, od razu uświadomi sobie, że został on zaprojektowany. W ten sam sposób biochemia otworzyła przed nami komórkę, aby zbadać, co powoduje jej funkcjonowanie - i widzimy, że ona także została zaprojektowana.
Ludzie żyjący w dziewiętnastym wieku byli zaszokowani, gdy odkryli na podstawie obserwacji, dokonywanych przez naukę, że wiele cech świata biologicznego można przypisać eleganckiej zasadzie doboru naturalnego. Dla nas, żyjących w wieku dwudziestym, jest niemniejszym szokiem odkrycie na podstawie obserwacji dokonanych przez naukę, że podstawowych mechanizmów życia nie można przypisać doborowi naturalnemu, a więc że zostały one zaprojektowane. Musimy się uporać z tym szokiem i iść dalej. Teoria niekierowanej ewolucji jest już martwa, ale dzieło nauki trwa nadal.
Michael J. Behe
Przypisy
[1] Przypis tłumacza: "Czarna skrzynka" - termin cybernetyczny oznaczający układ o nieznanym mechanizmie funkcjonowania, w którym dane są jedynie wejścia i wyjścia.
[2] Charles Darwin, The Origin of Species, New York University Press, New York 1988, s. 143-144 [tłumaczenie polskie: Karol Darwin, Dzieła wybrane. Tom II. O powstawaniu gatunków drogą doboru naturalnego czyli o utrzymaniu się doskonalszych ras w walce o byt, PWRiL, Warszawa 1959, s. 180].
[3] John Farley, The Spontaneous Generation Controversy from Descartes to Oparin, The Johns Hopkins University Press, Baltimore 1979, s. 74-75.
[4] Ernst Mayr, One Long Argument, Harvard University Press, Cambridge 1991, s. 146.
[5] T. M. Devlin, Textbook of Biochemistry with Clinical Correlations, John Wiley & Sons, New York 1986, s. 840-841.
[6] J.C. Kendrew, G. Bodo, H.M. Dintzis, R.G. Parrish, H. Wyckoff & D.C. Phillips, Nature 1958, vol. 181, s. 662-666.
[7] M. F. Perutz, Scientific American 1964, vol. 211, s. 64-76.
[8] J. U. Bowie & R.T. Sauer, Identifying Determinants of Folding and Activity for a Protein of Unknown Structure, Proceedings of the National Academy of Sciences USA 1989, vol. 86, s. 2152-2156; J.U. Bowie, J.F. Reidhaar-Olson, W.A. Lim & R.T. Sauer, Deciphering the Message in Protein Sequence: Tolerance to Amino Acid Substitution, Science 1990, vol. 247, s. 1306-1310; J.F. Reidhaar-Olson & R.T. Sauer, Functionally Acceptable Substitutions in Two-Helical Regions of Repressor, Proteins: Structure, Function, and Genetics 1990, vol. 7, s. 306-316.
[9] Reidhaar-Olson, Sauer, Functionally...
[10] D. Voet & J.G. Voet, Biochemistry, John Wiley & Sons, New York 1990, s. 1132-1139.
[11] J.w., s. 297-304.
[12] Przyp. tłum.: Autor ma na myśli słuchaczy, siedzących na sali w trakcie jego wykładu.
Źródło: Kazimierz Jodkowski, Metodologiczne aspekty kontrowersji ewolucjonizm-kreacjonizm, "Realizm. Racjonalność. Relatywizm", Wydawnictwo UMCS, Lublin 1998, s. 496-511. (Molecular Machines: Experimental Support for the Design Inference (maszynopis); zgodą Autora z jęz. ang. tłum. Kazimierz Jodkowski. Artykuł ten został zmirrorowany ze strony autora)